AVISO Por alguna razón no esclarecida, este boletín puede tener algunos problemas para visualizarse correctamente si se utiliza Microsoft Edge como navegador. Curiosamente, sucede de manera aparentemente caprichosa en distintos ordenadores con similar configuración de hardware y software, en unos sí, en otros no. Así que directamente te recomendamos utilizar Chrome, Firefox o Safari (en el caso de Mac), tanto en sus versiones para ordenador como en las de móvil y tablet.
GUÍA PRÁCTICA: CÓMO DAR MEDICAMENTOS A LOS NIÑOS DEPRESIÓN, ANTIDEPRESIVOS Y EL JAPÓN ANTIPSICÓTICOS EN LA DEMENCIA DURANTE LA PANDEMIA EMRACLIDINA CITISINA (TODACITAN®) COMO RETIRAR ANTIPSICÓTICOS DE LIBERACIÓN PROLONGADA UN PEQUEÑO REPASO AL GABA MONITORIZANDO NIVELES DE CLOZAPINA BETA-BLOQUEANTES Y CONDUCTA EL FUTURO DE LA PSICOFARMACOLOGÍA PSICODÉLICOS Y EMPATOGÉNICOS A VUELTAS CON EL “PEER REVIEW”
GUÍA PRÁCTICA: CÓMO DAR MEDICAMENTOS A LOS NIÑOS
Artículo que publica Australian Prescriber y que parte de la base, fácilmente aceptable, de que conseguir que los niños tomen medicación conlleva sus dificultades técnicas.

El rechazo por el sabor, la falta de comprensión, la habilidad para tragar sin atragantarse, la facilidad de la administración, son cuestiones especialmente relevantes en los más pequeños. Y, por otro lado, las precauciones en la dosificación y los posibles errores en las dosis, a las que son mucho más sensibles. Las formulaciones líquidas orales son las preferidas, tanto por la facilidad de ingestión como la de dosificación en proporción de la edad y el peso. Y también son más sencillos de enmascarar con otros sabores. Sin embargo, son también formulaciones más susceptibles de errores importantes en la dosificación, especialmente cuando se usan presentaciones preparadas para adultos en forma de gotas, en donde no es tan difícil confundir 1 ml por 0,1 ml (y multiplicar por 10 la dosis administrada). También suelen contener excipientes que pueden no ser adecuados para los niños (como el etanol, véase ejemplo de la furosemida en el propio artículo).
Con los formatos sólidos las cosas se pueden poner más complicadas, especialmente si nos ponemos a machacar pastillas y comprimidos o a vaciar cápsulas para mezclarlas con algo más fácil de tragar y menos asqueroso de sabor. No hay una edad exacta a la que un niño aprende a tragar pastillas, es una habilidad que tiene que ser aprendida (aquí os dicen cómo enseñarlo), pero en muchos casos no se consigue hasta los 8-10 años.

Los formatos sólidos tienen mucha menor flexibilidad a la hora de adaptar las dosis a la edad y el peso de la chiquillada y requieren operaciones complejas para machacarlas o cortarlas con razonable exactitud, a la par que dichas manipulaciones suelen hacer aún más evidente su mejorable sabor. Y esto no puede hacerse con los preparados de liberación modificada y puede ser más complejo con el contenido de las cápsulas.
En esta tabla el artículo resume las precauciones recomendaciones más importantes a la hora de dar medicinas a los niños y aquí lo hace con una infografía pensada para las madres y padres:
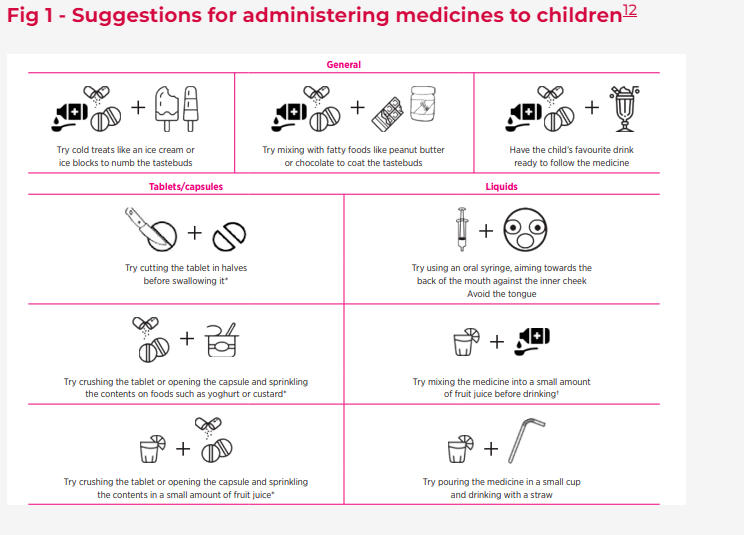
Otra tabla nos ilustra con la mejor manera de enmascarar el sabor de las distintas medicinas, no demasiado imaginativa, ya que incluye cosas como el chocolate, el caramelo o diversas frutas. Me ha defraudado que no se incluya a un clásico como son los quesitos.
DEPRESIÓN, ANTIDEPRESIVOS Y EL JAPÓN
Esta historia no por ser conocida deja de ser de mucho interés (y en cierto modo aleccionadora). Partimos de una reciente publicación que no puede catalogarse de científica, ya que se aloja en un suplemento dedicado a cosas como el bienestar, la gastronomía o la nutrición del diario digital El Confidencial. Pero vaya, nos vais perdonar, porque de este hilo vamos a tirar para recuperar esta más o menos enterrada historia de marketing y “flexibilidad” diagnóstica.

Y es que, aunque parezca mentira, a finales de los años 90 (con el Prozac ya cómodamente instalado en EEUU y Europa) el propio concepto de depresión en Japón como enfermedad era algo raro y limitado a las formas más graves y “biológicas” y claro, así no había manera de hacer negocio. Manos a la obra. Si no tenéis una cultura de la depresión, vamos a crearla.
A finales de los 80, Lilly había abandonado la idea de llevar el Prozac a Japón, país en el que no existía demanda de antidepresivos. De hecho, en los años 90, cuando el Prozac y sus diversos colegas ISRS ya eran un fenómeno cultural en EEUU y Europa, en Japón era básicamente desconocidos.

Esto empezó a cambiar cuando, allá por el año 1999, una compañía japonesa, Meiji Seika Kaisha, comenzó a comercializar la fluvoxamina. Al año siguiente GlaxoSmithKile le siguió los pasos, en este caso con la paroxetina.
En este contexto se inició un aluvión de ensayos clínicos, usando sus métodos de reclutamiento para su propia publicidad creando incluso un nuevo término, “kokoro no kaze” para sustituir el anterior ‘utsubyo’ (relacionado con las depresiones más graves y psicóticas): ahora serían literalmente los “resfriados del alma”, algo mucho más común, menos estigmatizante, curable y tratable con medicamentos accesibles; como el catarro, vaya. Y así el anterior “utsubyo”, poco común y muy grave, se convirtió en una epidemia de resfriados del alma que potencialmente afectarían a casi toda la población en un momento dado de su vida. No se libraron de esto ni los emperadores, la princesa Masako y el emperador Naruhito. Pero vaya, tampoco hay que pasarse, si la depresión es comparable a un mero catarro, ¿para qué tratarlo? Así que había que conseguir asociar la idea de que la depresión es algo común y puede afectar a cualquiera, pero que no tratarla puede ser muy peligroso. Por ejemplo, vinculando depresión y suicidio. Y así, los japoneses se han ido modernizando y tomando antidepresivos como el resto del mundo civilizado. El caso es que los diagnósticos de depresión se duplicaron en Japón en 4 años y para 2006 la venta de antidepresivos se había multiplicado por seis con respecto a ocho años atrás.

La fluvoxamina fue aprobada en Japón en 1999 y la sertralina en 2006. Duloxetina se aprobó en 2010. Citalopram y fluoxetina no han recibido aprobación, aunque sí el escitalopram, en 2011. Mirtazapina se aprobó en 2009. Vortioxetina en 2019.
ANTIPSICÓTICOS EN LA DEMENCIA DURANTE LA PANDEMIA
Lo publica JAMA Psychiatry hace unos días. La pregunta es…¿aumentó la prescripción de antipsicóticos a personas con demencia durante la pandemia?

Los autores examinaron los datos de más de 850.000 personas diagnosticadas de demencia de 6 países, incluyendo Corea del Sur, Francia, Alemania, Italia, Reino Unido y EEUU. Su conclusión es que sí, que la prescripción de antipsicóticos se incrementó significativamente en esta población en los primeros meses de la pandemia y que este incremento se mantuvo durante 2021. La explicación general más obvia es que la pandemia puso patas arribas la atención a estas personas, no solo en las residencias, y que las dificultades de atención, el confinamiento, los aislamientos, la afectación del entorno familiar, las dificultades de acceso al sistema sanitario, etc. etc., pudieron generar alteraciones emocionales y conductuales que se trataron de paliar con medicación antipsicótica. Teniendo en cuenta que la efectividad de los antipsicóticos en estas cosas es escasa y su probabilidad de generar efectos secundarios elevada (incluyendo incremento de mortalidad), seguramente esto habrá tenido diversas consecuencias. La propia revista dedica un editorial al asunto, al empeoramiento de los síntomas conductuales, psicológicos y emocionales de la demencia durante la pandemia y, en general, al difícil manejo de estos síntomas

EMRACLIDINA
Como dice el artículo, que publica Lancet, la emraclidina es un modulador alostérico altamente selectivo de receptores M4 (receptores muscarínicos) que se anda probando como posible tratamiento de la esquizofrenia. El estudio que se presenta es un fase 1b, es decir, lo que examina es básicamente su tolerancia y seguridad y ajustar las dosis más adecuadas

El hecho de que se presuma un mecanismo de acción colinérgico ya resulta un tanto novedoso, aunque el mareo de las modas de neurotransmisores que llevamos tantos años viviendo nos hace ser poco impresionables al respecto. Por el momento, parece que el ensayo no ha encontrado graves efectos secundarios, lo que abre las puertas a seguir adelante con las siguientes fases de ensayos. En nuestro boletín Nº 71 ya hicimos mención a otro candidato con efectos agonistas M1/M4, la xanomelina, cuyos efectos secundarios derivados de su acción colinérgica periférica obligaban a combinarlo con un anticolinérgico y que ya ha sido ensayado en un fase 2. Ya veremos si seguimos oyendo hablar de ello en el futuro o se quedan por el camino…
CITISINA (TODACITAN®)
Tras la retirada del mercado de la vareniclina y el bupropion (Champix® y Zyntabac®), se anuncia la financiación de este “nuevo” medicamento para la deshabituación tabáquica. ¿Qué es la citisina? Pues un alcaloide que se encuentra en algunos tipos de arbustos y plantas leguminosas y que tiene propiedades agonistas de receptores nicotínicos. No es, desde luego, una desconocida, fue descubierta en 1818 y sintetizada por primera vez en 1864. Hace ya muchos años que se conocen sus propiedades sustitutivas del tabaco y está documentado su uso por soldados rusos y alemanes en la segunda guerra mundial (suponemos que no por deseos de dejar de fumar, sino por falta de tabaco…) y ha sido utilizada durante décadas en la Europa del este.

Hay muchos ensayos clínicos que sustentan su eficacia, éste mismo, publicado muy recientemente y realizado en grandes fumadores incluidos en programas de cribado de cáncer de pulmón.

Por lo que sabemos, su financiación y prescripción en el sistema público estará condicionado por la inclusión en un programa más amplio de deshabituación tabáquica establecido en cada CCAA.
COMO RETIRAR ANTIPSICÓTICOS DE LIBERACIÓN PROLONGADA
Lo publica Current Psychiatry, ilustrado, como suele ser habitual, por un caso clínico. Es mucho más común en la práctica clínica la situación contraria, la de sustituir un antipsicótico oral por otro de liberación prolongada y, normalmente, tendremos más claras las pautas para hacerlo. En este caso se trata de cambiar el antipsicótico inyectable por medicación oral, tanto si el cambio es al mismo fármaco con distinta formulación o a un antipsicótico distinto. El artículo aporta datos farmacocinéticos de diversos antipsicóticos de liberación prolongada y de sus niveles en rango terapéutico que debieran a ayudar a decidir cuándo iniciar la medicación oral tras el último inyectable.

UN PEQUEÑO REPASO AL GABA
Por cortesía de nuestro admirado Scott Alexander y su blog Astral Codex Ten, un repasito sobre este neurotransmisor, el principal neurotransmisor inhibitorio en nuestro cerebro. Aquí nos vamos a centrar (se centra Scott, fundamentalmente) en su receptor GABA-A, el más común;
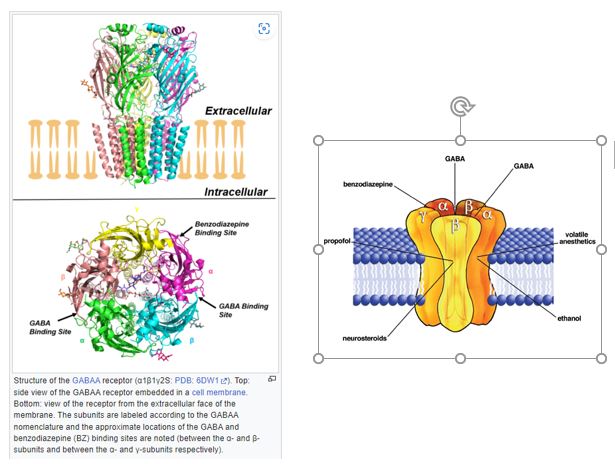
El receptor GABA-A es “heteropentamérico”, es decir, está compuesto por cinco subunidades potencialmente diferentes. Por lo general, un GABA-A está compuesto por dos subunidades alfa, dos subunidades beta y una subunidad adicional (generalmente una gamma). Hay diferentes tipos de subunidades alfa, beta y gamma, denominadas cosas como “alfa-1”, “alfa-2”, etc. Por ejemplo, el tipo más común de receptor GABA se llama α1β2γ2, lo que significa que está compuesto por dos unidades α1, dos unidades β2 y una unidad γ2. Este sistema de nombres asume que ambas unidades α (y así sucesivamente para las unidades β) serán del mismo tipo, lo cual suele ser cierto, aunque ocasionalmente hay algunas excepciones.
Los benzodiacepinas son los fármacos psiquiátricos que afectan al GABA por excelencia; parecen afectar solo a los receptores con subunidades alfa tipos 1, 2, 3 y 5, lo que haría previsible sus efectos sedantes, ansiolíticos, que afecten a la memoria o que puedan causar dependencia…
MONITORIZANDO NIVELES DE CLOZAPINA
Una excelente guía sobre este asunto, que tan a menudo usamos con ligereza.
Ligereza porque con cierta frecuencia se usa de manera rutinaria, cuando realmente solo es útil en determinadas circunstancias, a saber:
- Cambios relevantes en al consumo de tabaco
- Necesidad de controlar el cumplimiento del tratamiento.
- En pacientes con mala respuesta al tratamiento
- Al reducir dosis
- Si se dan efectos secundarios o posibles interacciones medicamentosas
- Sospecha de dosis excesiva; pacientes con dosis elevadas sin evaluación previa de niveles
- Toma de niveles de referencia tras buena respuesta del paciente a una determinada dosis.
La guía repasa todos los aspectos relevantes acerca de la monitorización de niveles de clozapina, incluyendo la interpretación adecuada de los niveles, las posibles interacciones medicamentosas, factores externos que pueden afectarlos o la relación de los niveles con efectos secundarios comunes con clozapina como el estreñimiento o las convulsiones. Excelente material para preparar una sesión clínica.
Y al hilo de esta entrada, un estudio realizado en Londres evaluaba precisamente el uso de los niveles de clozapina en la clínica cotidiana, con algunas conclusiones un tanto sorprendentes: el 97% de los 316 pacientes en tratamiento con clozapina incluidos en la muestra había sido sometido a una prueba de niveles en el periodo de evaluación; sólo el 45% tenían niveles en rango terapéutico aceptable. Y en el 42% de ellos no había evidencia alguna de que dichos niveles fueran revisados por los clínicos.

BETA-BLOQUEANTES Y CONDUCTA
Se trata de un estudio poblacional longitudinal, de esos que coges los datos de un montón de gente durante un periodo de tiempo, los metes en la batidora, le pasas los análisis estadísticos pertinentes y tratas de establecer correlaciones. Estas cosas las suelen hacer los países nórdicos, que cuentan con bases de datos poblacionales extensas y completas, en este caso son suecos los que cogen a casi millón y medio de compatriotas con prescripciones de beta bloqueantes y los siguen durante un periodo de 8 años. Y cruzan ese dato (ser sueco, mayor de 15 años y tener prescrito un beta bloqueante) con hospitalizaciones psiquiátricas, suicidios y conductas suicidas y detenciones por crímenes violentos. Los autores encuentran que las personas en tratamiento con beta bloqueantes tuvieron un riesgo un 8% menor de sufrir una hospitalización psiquiátrica, un riesgo un 8% superior de mostrar conductas suicidas o suicidios consumados y un 13% de reducción del riesgo de ser detenido por crímenes violentos.

Aprovechamos para recordar que los beta bloqueantes han sido utilizados en psiquiatría desde hace más de 40 años, especialmente en el tratamiento de la ansiedad, pero también se han ensayado en el manejo de efectos secundarios como el temblor provocado por el litio, la akatisia inducida por neurolépticos o para otras condiciones como la depresión (concretamente el pindolol, como potenciador antidepresivo), el trastorno por estrés postraumático y la conducta agresiva, como nos recuerda este artículo de revisión.

EL FUTURO DE LA PSICOFARMACOLOGÍA
World Psychiatry publica esta extensa revisión y reflexión en torno a eso, al futuro de los tratamientos psicofarmacológicos, con una evaluación crítica de los ensayos clínicos fase 2 y 3 en curso sobre nuevos medicamentos.

Al hilo del artículo, un comentario publicado en el mismo número de la revista se hace eco de la actual crisis de desarrollo de nuevos psicofármacos aportando algunos datos: en la década transcurrida entre 2011 y 2021, la FDA aprobó 12 nuevos medicamentos con indicaciones psiquiátricas; en comparación, en el mismo periodo, aprobó 50 con indicaciones en neurología y 135 con indicaciones oncológicas. Y solo dos de los medicamentos psiquiátricos fueron considerados innovadores, es decir, con mecanismos de acción novedosos (la FDA los llama “first in class”), por 13 en neurología y 31 en oncología (esta vez refiriéndose al periodo 2015-2021).

Un posible factor que contribuya a esta situación puede estar relacionado con las crecientes dificultades para llevar a cabo ensayos clínicos en psiquiatría, con muy alta respuesta del grupo placebo, lo que conlleva ensayos clínicos muy grandes y muy caros. El caso es que grandes compañías con importante tradición en el ámbito de la psiquiatría como Glaxo-SmithKline, Eli Lilly, Pfizer o Astra Zeneca se han retirado de la carrera del desarrollo de nuevos medicamentos psiquiátricos. Otra cuestión reseñable y poco dada a la esperanza es que muchos de los nuevos medicamentos en desarrollo tienen como diana los mismos mecanismos de acción que medicamentos ya comercializados, con muy pocos verdaderos nuevos medicamentos potenciales en cartera. Una excepción reseñable es la investigación en psicodélicos como la psilocibina (un agonista de receptores serotoninérgicos 2A), algo de lo que hablaremos en la siguiente entrada. En todo caso, el problema fundamental subyacente para descubrir nuevos caminos es el escaso conocimiento acerca de la fisiopatología de las enfermedades mentales y su relación con los síntomas psiquiátricos. La serendipia que tanto nos ha ayudado en el pasado no es esperable que nos eche de nuevo una mano. Esta situación de cierta vía muerta se refleja también en el informe sobre medicamentos humanos 2022 que publica la Agencia Europea del Medicamento (EMA).
La EMA recomendó la aprobación de la autorización de 89 nuevos medicamentos, de los que 41 contienen nuevas sustancias activas; medicamentos oncológicos, para enfermedades infecciosas, neurológicas, hematológicas, endocrinas, reumatológicas, nefrológicas, dermatológicas…Ninguna relacionada con indicaciones psiquiátricas. La EMA designa como medicinas prioritarias (PRIME) aquellas que, con resultados prometedores, afrontan necesidades terapéuticas no cubiertas; en este caso la EMA facilita los trámites de evaluación para acelerar su disponibilidad. Se incluyen en este procedimiento 13 medicamentos a lo largo de 2022 y se aprobaron 8 previamente incluidos en PRIME. Ninguno de ellos con indicaciones psiquiátricas.
Volviendo a Correl y a su revisión, hay que decir que la introducción que realiza previamente al análisis de los ensayos en curso contiene algunas reflexiones de mucho interés que animo a leer en el artículo original y que no me animo a transcribir aquí, que se me hace largo.
La revisión de los ensayos comienza con los tratamientos de la esquizofrenia, 176 fase 2 y 3, aunque únicamente 12 moléculas, testadas en 42 ensayos, han conseguido mejorar al placebo en 13 ensayos con resultados positivos. Por aquí desfilan ensayos con la combinación de xanomelina y trospium, la emraclidina, el ulataront, la blilaroxazina, el raloxifeno, o la ruloperidona entre otros, con variados mecanismos de acción que incluyen receptores cannabinoides, colinérgicos, dopaminérgicos, estrógenos, GABA, glutamato, mecanismos inflamatorios, inmunológicos, etc.
En el caso del T Bipolar se identifican 38 ensayos en curso, en los que únicamente 6 moléculas probadas en 11 ensayos obtuvieron resultados positivos en 6 de ellos. Uno de ellos, curiosamente, usando una combinación de los veteranos N-acetil-cisteína y ácido acetil salicílico. Si nos ceñimos a la depresión mayor, se identifican 177 ensayos en curso, con 19 moléculas que sometidas a 43 ensayos han obtenido resultados positivos frente a placebo en 19 de estos ensayos (algunos ya aprobados y comercializados, como esketamina) incluyendo a la combinación de desxtrometorfano y bupropion, esmethadona o la brenaxolona (también aprobada y comercializada) y la zuranolona en la depresión postparto. Y así sigue revisando ensayos para los trastornos de ansiedad y postraumáticos (con candidatos para la ansiedad generalizada, el estrés postraumático o las crisis de pánico, pero sorprendentemente o no, ninguno para el TOC), las adicciones o la demencia (record de ensayos en curso, 265, con 14 moléculas que han superado al placebo en 15 de los 27 ensayos a los que han sido sometidas). El artículo analiza, después de este repaso, aspectos como la validez de los ensayos clínicos, su diseño, la respuesta a placebo, el reclutamiento de pacientes, la evaluación de resultados o los análisis estadísticos. Trabajoso, largo, pero muy recomendable.
PSICODÉLICOS Y EMPATOGÉNICOS
Pues al menos para nosotros, lo de empatogénico (así hemos traducido “empathogenic), resulta algo novedoso. Se trata de una declaración oficial de la APA acerca del uso de este tipo de sustancias en el tratamiento de enfermedades mentales. Ayahuasca, LSD o psilocibina, por el lado de los psicodélicos y empatogénicos como la MDMA, el MDBD o el MDE (todos derivados anfetamínicos). Ah, denominan agentes empatogénicos a sustancias con efectos sobre la autopercepción y las relaciones sociales, pero sin efectos alucinógenos. La declaración reconoce su posible potencial terapéutico, pero recuerda que son tratamientos en proceso de investigación y que sus riesgos a corto y largo plazo no están establecidos. Básicamente piden precaución ante la expectativa creada y la tentación de usar atajos.
El New England, por su parte, dedica un podcast (que transcribe a texto también), acerca de esa misma cuestión, la promesa y los riesgos que suponen los psicodélicos, en forma de diálogo entre una participante en un ensayo clínico con psilocibina y una investigadora de dicho campo.
Y bueno, como esta viñeta ilustra, los ensayos clínicos de psicodélicos tienen sus dificultades con el doble ciego y el grupo placebo…

A VUELTAS CON EL “PEER REVIEW”
No sabemos quién es Adam Mastrianni ni como hemos llegado a este post en su blog “Experimental History”; pero nos ha parecido interesante por su manera de poner en cuestión algo aparentemente incuestionable: la revisión por pares de artículos científicos.
Adam nos cuenta que durante más de medio siglo ha venido desarrollándose un enorme experimento más o menos espontáneo, sin grupo control ni aleatorización y sin que nadie lo dirigiera. Un experimento masivo que incluía a todos los científicos de la tierra, sin que siquiera se dieran cuenta. El experimento parte de una hipótesis: se hará mejor ciencia y progresaremos más si hacemos que otras personas revisen los artículos y rechacen la publicación de los que no pasen el examen. Desde luego, un cambio radical sobre los usos y costumbres previos de los científicos, que se limitaban a escribir sus cosas y descubrimientos, enviarlos a sus colegas por correo y en algunas ocasiones recibir la visita de la iglesia católica u otros poderes del momento que no se mostraran muy de acuerdo con el supuesto avance científico en cuestión (movimientos de planetas y soles incluidos); hay que tener en cuenta que las revistas científicas ya existían en el siglo XVII, aunque no fueran demasiado selectivas en sus publicaciones. Adam nos cuenta que el propio Einstein solo sometió a revisión por pares uno de sus artículos y que el tener que hacerlo no le hizo ninguna gracia. A partir de los años 60, la revisión por pares empezó a extenderse, así como la competición por publicar, sometida a su dictado. Adam dice que este enorme experimento ha fallado.
Y es que este proceso es muy costoso y muy caro; obliga a dedicar mucho tiempo a los revisores, también científicos, y retrasa meses o años las publicaciones; las universidades y otras instituciones se gastan millonadas en pagar el acceso a las revistas científicas que, por su parte, emplean gratis a los revisores y a los propios autores. Podría argumentarse que merece la pena, porque la ciencia que se produce y divulga es ahora de mucha mayor calidad, pero esto es bastante dudoso; en muchos campos distintos, los resultados de la investigación se han estancado, muchos hallazgos publicados tras revisión por pares no se replican y hay diversos ejemplos de otros enteramente falsos, total o parcialmente inventados o manipulados. Y es que… ¿La revisión por pares realmente hace lo que se supone que debe hacer? ¿Identifica la mala investigación y evita que se publique? Parece que no. Hay estudios en los que se remiten deliberadamente artículos con errores gruesos cuya detección no llegó al 30%. Cosas como decir que se trata de un ensayo clínico aleatorizado sin serlo, gráficos que en realidad no muestran efecto alguno o conclusiones que no están absolutamente respaldadas por los resultados, colaron con frecuencia.
¿Qué hacen la mayoría de los investigadores cuando reciben los comentarios y consejos que acompañan el rechazo del artículo? ¿Revisan los datos, repiten ensayos, reescriben en profundidad el artículo, lo echan directamente a la basura? Pues parece que, en general, lo que hacen es enviarlo a otras revistas, generalmente rebajando el listón de impacto hasta que alguna lo acepta.
En todo caso, en los asuntos de la comunicación científica hay dos mundos paralelos: el de la publicación en revistas de impacto revisadas por pares que va construyendo los cimientos de tu carrera (y la financiación de las nuevas investigaciones) y el de la comunicación informal, blogs, documentos varios, charlas, quizás hasta twitter, donde se gestan ideas y proyectos, se comunican descubrimientos y se discute sobre los mismos sin mayor control ni revisión que la que ejerce la propia comunicación entre colegas.
Sydney Brenner, un biólogo que ganó el premio Nobel de Fisiología y medicina en 2002 (fallecido en 2019) venía a decir algo así:
Y, por supuesto, todos los académicos dicen que tenemos que tener una revisión por pares. Pero no creo en la revisión por pares porque creo que está muy distorsionada y, como he dicho, es simplemente una regresión a la media. Creo que la revisión por pares está obstaculizando la ciencia. De hecho, creo que se ha convertido en un sistema completamente corrupto. Es corrupto de muchas maneras, en el sentido de que los científicos y académicos han entregado a los editores de estas revistas la capacidad de emitir juicios sobre la ciencia y los científicos. Hay universidades en Estados Unidos, y lo he escuchado de muchos comités, que dicen que no consideran las publicaciones de las personas en revistas de bajo factor de impacto. Ahora ya no se trata de no publicar o perecer, sino de publicar en los lugares correctos…. o perecer. Y esto ha reunido a un grupo de personas de lo más ridículo. Escribí una columna durante muchos años en los años noventa, en una revista llamada Current Biology. En un artículo, "Casos difíciles", hice campaña contra esta cultura porque creo que no solo es mala, sino también corrupta. En otras palabras, pone el juicio en manos de personas que realmente no tienen ningún motivo para ejercer el juicio. Y todo eso se ha hecho por negocio, porque ahora son organizaciones gigantes las que ganan dinero con eso.
Hace ya casi 25 años, ya nos advertía un editorial del olvidado boletín THMNews del problema del negocio de las publicaciones científicas con una propuesta muy sensata pero que, como es evidente, no llegó a prosperar: penalizar la investigación basura. Y es que ya entonces se publicaban dos millones de artículos en 30.000 revistas médicas al año, de los que el 99% no aportaban nada al conocimiento y mucho al ruido. Publicar ya se había convertido entonces en un fin en sí mismo, obtener fondos de investigación, mantener tu trabajo, respaldar a la industria farmacéutica y a la psicológica, no en generar conocimiento, salvo honrosas excepciones.
Y todo esto, por asociaciones, nos trae a la memoria otra historia hoy en día poco conocida por olvidada; en 1999, Harold Varmus (premio Nobel de fisiología y medicina en 1989, director del NIH y del instituto Nacional del Cáncer en EEUU) propuso una iniciativa llamada PubMed Central (PMC), diseñada para crear un repositorio central de toda la literatura generada relacionada con las ciencias de la vida en general y de acceso libre.
En aquellos tiempos, hace ya casi 25 años, seguimos esta historia con interés, con la expectativa de que el proyecto de Harold, el acceso gratuito a los artículos de investigación ubicados en un servidor de Internet, iba a revolucionar la publicación científica, algo, que, evidentemente, no ha sucedido. El proyecto inicial de Varmus se denominaba E-Biomed y estaba dirigido a alentar las publicaciones electrónicas (recordad que estamos hablando de 1999) de estudios clínicos e investigaciones relacionadas con la biología celular y molecular y en general con la investigación biomédica. Y esto no hizo mucha gracia a las grandes editoras. Como buen ejemplo, el editorial del New England del 10 de junio de 1999, que en su título calificaba la iniciativa de amenaza potencial a la evaluación y a la difusión ordenada de los estudios clínicos.

Y en este editorial, su autor, un antiguo editor de la revista, Arnold Relman, decía, visiblemente molesto con la idea:
La mejor manera de proteger el interés público es a través del sistema existente de revisión por pares, revisión y comentarios editoriales cuidadosamente monitorizados en las revistas y programando la divulgación pública para que coincida con la fecha de publicación de la revista. Los errores, imprecisiones y malas interpretaciones en la investigación clínica representan un riesgo mucho mayor para la salud y el bienestar público que los errores en la investigación científica básica. Un sistema que permitiera la publicación electrónica inmediata de nuevos estudios clínicos sin el proceso cuidadoso habitual de revisión y revisión por pares sería, en el mejor de los casos, arriesgado y bien podría llenar las bases de datos clínicos con información engañosa y evaluada inadecuadamente.
Ni qué decir tiene que, al final, el oligopolio de las editoriales en la publicación científica no solo ha mantenido su negocio, sino que lo ha incrementado; con las excusas de ser los guardianes de la rigurosidad y los garantes de la publicación de investigación de calidad, mantienen un sistema en el que los investigadores hacen el trabajo, muchas veces pagados por instituciones y universidades públicas, en investigaciones que reciben también financiación pública, compiten por publicar en revistas privadas, que además les solicitan sean revisores gratuitamente y, finalmente, las mismas instituciones y universidades pagan por el acceso a las revistas y artículos que ellos mismos producen. En realidad, cinco grandes editores controlan la mitad del mercado editorial biomédico: la holandesa Reed-Elsevier, la americana SAGE, la alemana Springer, y las británicas Taylor & Francis y Wiley-Blackwell.

En resumen, un plan de negocio redondo:
Los mejores investigadores y académicos del mundo, que trabajan en algunas de las instituciones más prestigiosas del mundo, invierten miles de horas investigando…
- Los gobiernos y las fundaciones subvencionan la investigación con cientos de millones de dólares (y euros)
- “Voluntarios” revisan los artículos previamente a su publicación, controlando así la calidad del producto de forma gratuita
- El producto resultante, una vez aprobado, se entrega al editor de forma gratuita, legalmente y con sus derechos de autor, a pesar de no haber invertido nada en el proceso
- Y el editor luego se lo vende a los propios investigadores y a las instituciones que les emplean a precio de monopolio
www.psicobotikas.eus
RSMB2023
Todas las imágenes, vínculos a páginas y referencias utilizadas en este boletín tienen como objetivo la divulgación de información relevante para la práctica asistencial, en el marco del principio de uso razonable y, en ningún caso, suponen ánimo de lucro. Sin embargo, estamos dispuestos a retirarlas en caso de cualquier reclamación por posible infracción de las leyes de propiedad intelectual